Introduction

Doit-on enlever la batterie lorsque le portable est sur secteur ? Puis-je redonner un coup de jeune à une batterie qui perd son autonomie après 20 minutes ? Est-ce qu’il faut la décharger totalement et surtout, comment gagner de précieuses minutes sur mon ordinateur portable ? Si nous abordons ce sujet en nous concentrant sur les accumulateurs Li-ion et les ordinateurs portables, certains paragraphes de cette première partie pourront s’appliquer à d’autres appareils. En effet, les batteries Li-ion envahissent notre monde (2 milliards de cellules sont produites chaque année) et marquent une nouvelle tendance. L’homme renaît de nouveau et après le cordon ombilical, il coupe tous les fils qui se placent devant lui. Wi-Fi, WUSB, Bluetooth, WiMAX, coupons alors le plus présent des fils, l’espace d’un instant. Rompons le câble d’alimentation !
À l’intérieur d’un accumulateur Li-ion

Anode cathode et autre
Une batterie est composée de plusieurs éléments assemblés les uns aux autres. Nous avons tout d’abord les accumulateurs (ou accus) qui emmagasinent l’énergie. Ce sont généralement (mais pas forcément) des cylindres rigides (ressemblant aux piles traditionnelles), car ils sont peu chers à fabriquer, offre une bonne densité, une bonne résistance à la pression interne et sont stables mécaniquement. Vous entendez souvent parler d’une batterie 6, ou 9 cellules dans les articles ou actualité. Sachez qu’un accumulateur correspond à une cellule. Une batterie 6 cellules contient donc 6 accus.
Sécurité
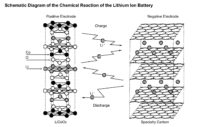
La cellule est composée principalement de trois éléments : l’anode (électrode négative), la cathode (électrode positive) et de couches séparant les deux faites de polyéthylène ou polypropylène. Ces couches contiennent des pores qui ont la particularité de se fermer à partir de 130°C dans le but de stopper toute réaction chimique dans le cas où la batterie surchaufferait. Les fabricants intègrent aussi divers éléments assurant la sécurité de l’accu, comme une membrane qui casse si la pression interne est trop grande. Lorsqu’elle se rompt, la cellule fonctionne à circuit ouvert ce qui doit en principe réduire la pression. Si cela n’est pas suffisant, une valve s’ouvre afin d’éviter que le cylindre craque.
Au moment de la fabrication, les constructeurs placent un PTC (Positive Temperature Coefficient) sous le plus de la pile. Il est en principe impossible d’ôter le PTC sans détruire la cellule. Son but est de réagir à l’élévation de la température et dès que le seuil auquel il a été programmé est atteint, il réduit ou stop le flot de courant dans le but de faire baisser la température. Les piles disposent aussi d’un joint d’étanchéité pour éviter toute fuite. Malgré toutes ces mesures de sécurité, les accumulateurs li-ion restent dangereux comme l’ont montré les déboires de Sony. Sans aller à la paranoïa, ces accus demandent néanmoins une certaine vigilance dans la fabrication et la manipulation.
La place du lithium
Une question reste néanmoins en suspend. Pourquoi les nomment-ont batterie Li-ion ou Lithium-ion. Le lithium est présent au sein des électrodes positives, négatives et de l’électrolyte. C’est le plus léger de tous les métaux et il dispose de propriétés électrochimiques excellentes ce qui offre une large densité énergétique par rapport à son poids (deux fois celle du Ni/Cd). Néanmoins, le lithium n’est pas présent sous sa forme métallique, mais ionique, d’où le nom Lithium-Ion. La raison est que la forme métallique n’était pas commercialisable pour des raisons de sécurité. L’inhérente instabilité de la structure poussa les industriels à choisir les ions de lithium, certes d’une moins bonne densité énergétique, mais se révélant beaucoup plus sûrs.
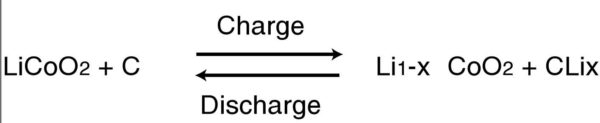
La cathode est en principe composée de dioxyde de Cobalt, mais l’on trouve des modèles utilisant du manganèse. De son côté, l’anode utilise des sphères de graphites depuis les recherches de Bell Labs en 1997, aussi appelé MCMB (Meso Carbon Micro Beads). L’électrolyte est composé d’un sel conducteur. Au final, on obtient la réaction suivante.
Tout ce petit monde est entouré d’une couche d’isolant. La partie positive de la pile est enrobée d’aluminium contrairement à la partie négative qui contient du cuivre.
À l’extérieur d’un accumulateur Li-ion
En théorie, les cellules peuvent être placées en série ou en parallèle. En pratique, dans les ordinateurs portables, on rencontre les deux à la fois. Par exemple, la batterie de notre ordinateur de test (un Fujitsu Siemens M3438G-75005) dispose de 8 cellules. Quatre accus Samsung ICR-18650 de 3,7 V sont montées en série afin d’obtenir une tension de 14,8 V (3,7 x 4) sur deux « lignes » parallèles afin d’accroître la capacité qui passe à 4 400 mAh. La charge électrique de chaque accu est de 2 200 mAh que l’on multiplie par deux puisqu’il y a deux lignes parallèles. Une telle configuration se nomme 4S2P (4 accus en série, 2 lignes parallèles), mais on peut trouver des batteries neuf cellules de type 3S3P ou douze cellules de type 4S3P. Attention, chaque batterie fera appel à des piles différentes et donc la tension ou l’intensité, tout comme la charge électrique peut changer en fonction des modèles.
Circuit électrique
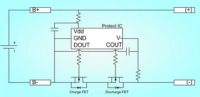
La batterie est aussi composée d’un circuit électronique extrêmement important puisqu’il assure le bon fonctionnement et la sécurité de la batterie. Ce circuit est composé en principe d’un transistor (FET – Field Effect Transistor) qui coupe tout si la tension de charge dépasse la valeur nominale de 0,1 V, ainsi qu’un fusible qui saute si la température approche les 90 C. Plusieurs types de fusible sont utilisés. Certains grillent de façon permanente une fois que le filament est détruit, d’autres peuvent être réactivés. On trouve aussi un interrupteur qui réagit si la pression interne est trop grande (plus de 10 Bars) en coupant le courant. Le circuit présent sur une batterie à plusieurs cellules veille aussi à la tension de chaque cellule et à la tension des connexions entre les cellules. Il tente aussi de prévenir toute sur-décharge en coupant le courant si l’on descend en dessous de 2,50 V/cellule.
Attention danger ?
La peur bleue des fabricants reste l’électricité statique ou un chargeur défectueux, qui viendrait endommager le circuit électrique. Un tel dommage pourrait coincer le fusible en position ON, sans que l’utilisateur soit au courant. En gros, le circuit électrique ne remplit plus sa première fonction qui est de couper le courant lorsque les conditions de fonctionnement deviennent hasardeuses. En pratique, il s’agit surtout, à notre connaissance, d’un cas d’école, mais cela renforce la nécessité d’utiliser le chargeur fourni par le constructeur.
À titre indicatif, sachez que si les fabricants d’ordinateurs portables font très attention à la batterie qu’ils vendent, ce n’est pas le cas dans d’autres secteurs et l’on peut parfois trouver des batteries au lithium-ion ayant une électronique minimum ou dépourvue de toute l’électronique nécessaires à la sécurité de l’utilisateur. Les constructeurs d’ordinateur portable sont aussi très discrets sur les technologies employées et il nous fut relativement difficile de rentrer dans le détail de la composition d’une cellule Li-ion. Chaque constructeur dispose de sa propre formule qui est extrêmement bien gardée.
Le cas des batteries enflammées

Certains remarqueront que 2004, est une date relativement tardive par rapport à la naissance et l’évolution des ordinateurs portables. À vrai dire, il existait déjà quelques normes auparavant. Elles avaient pour défaut de se concentrer sur les cellules en omettant le packaging et l’électronique ou vice versa. L’IEEE 1625 est donc venu uniformiser tout cela en apportant un standard touchant tous les éléments d’une batterie individuellement et conjointement.
Baptême de feu

Juin 2006, l’ordinateur portable Dell d’un journaliste prend feu dans une salle de conférence au Japon (cf. « Ce soir Dell vous met le feu… »). Une enquête est ouverte et les premiers éléments penchent vers un problème de surchauffe de batterie. Juillet 2006, ces suppositions sont confirmées par des tests en laboratoires et chose encore plus surprenante, on apprend que Dell était au courant (cf. « Explosion de portables : les batteries en cause »). Août 2006, on apprend que les batteries défectueuses ont été fabriquées par Sony et qu’elles n’ont pas été seulement distribuées à Dell, mais à HP, Apple, Lenovo, Fujitsu, Hitachi et d’autres encore.
Retour à la réalité

Mais au lieu de prendre ce problème sérieusement, certains constructeurs, comme Sony, ont longtemps retardé le rappel des batteries défectueuses. Devant le soulèvement massif des consommateurs, l’inévitable arriva néanmoins et tous les constructeurs (même les plus réfractaires) rappelèrent leurs produits. Au total, près de 10 millions de batteries furent rappelées pour un coût autour de 430 millions de dollars. L’autre conséquence fut une levée de l’IEEE qui annonça en septembre 2006 la révision du standard IEEE 1625. Cette révision est censée accompagner la naissance d’un nouveau standard, l’IEEE 1825 visant en plus des batteries au lithium-ion, les batteries au lithium-ion polymères.
Charger et décharger sa batterie
Nous avons des habitudes qui datent du temps des batteries Ni/Mh. Il est donc important de revenir sur l’utilisation de la batterie du moment où on l’utilise la première fois jusqu’au moment où on la jette.
Attention à la décharge
Il ne faut pas décharger totalement la batterie dès sa réception. Au contraire, il convient de la recharger totalement sans interruption. En fait, il ne faut jamais décharger la batterie entièrement sous peine de perdre 20 % de sa capacité d’un seul coup ! Les systèmes d’exploitation veillent généralement sur ce point et s’éteignent avant que la batterie n’ait plus d’énergie. Cet impératif vient du fait que les accus sont couplés à un circuit électronique complexe qui doit constamment être alimenté. De plus, une décharge totale entraîne une dégradation chimique des éléments au sein de l’accumulateur. À cause de cela, une recharge de la batterie (après une décharge totale) peut être potentiellement dangereuse. C’est pour cela qu’un circuit interne peut empêcher la recharge afin d’éviter tout incident. Cela aura aussi pour conséquence de rendre la batterie inutilisable. Il est déconseillé de décharger plus de 95 % de sa batterie, dans la mesure du possible. De plus petites recharges sont souvent le plus appropriées.
Cycle de charge/décharge
Contrairement à ce que l’opinion publique laisse entendre, le nombre de cycle de recharge n’est pas identique au nombre de fois que l’on recharge la batterie. Confus ? Par exemple, votre batterie descend à 50 % de charge. Vous la rechargez à 100 %, puis recommencez l’opération. Vous venez de rechargez votre batterie deux fois, mais deux recharges de 50 % correspondent à un seul cycle de recharge. Contrairement donc à une idée reçue, il n’est pas nécessaire d’attendre que la batterie soit vide pour recharger. D’ailleurs, comme nous l’avons vu plus haut, c’est même tout le contraire. Enfin, la batterie devrait avoir une température comprise entre 0 et 45°C au moment de la charge. En dessous de cet intervalle, le lithium se plaque contre les électrodes, au-dessus la pression devient trop grande. Dans les deux cas, cela peut potentiellement rendre la batterie instable. Généralement, si la température de charge dépasse vraiment les 45°C, il arrive qu’un circuit coupe la charge, laissant penser que la batterie est pleine alors qu’elle ne l’est pas. On estime que la température optimale est de 20°C. Comme nous le verrons plus tard, la température de fonctionnement (charge ou décharge) est un élément important dans la vie d’une batterie. Il faut donc être particulièrement attentif.
À toute règle son exception. Il est conseillé, lors des premières utilisations, de charger pleinement la batterie puis d’atteindre le seuil critique de l’ordinateur portable (5% de charge), sans recharge intermédiaire et sans descendre en dessous de cette limite. Une fois le seuil atteint, on la recharge totalement. Contrairement à ce que beaucoup pensent aujourd’hui, cette manœuvre n’est pas faite pour roder la batterie et la faire gagner en capacité, mais simplement pour affiner les systèmes mesurant le niveau de charge. C’est ce que l’on appelle la calibration, car cela permet de calibrer le système de mesures qui pourra alors donner une estimation plus précise de l’énergie restante. En moyenne, il est conseillé de calibrer sa batterie tous les mois, surtout si vous effectuez le plus souvent de petites recharges.
Perte normale
Les accumulateurs Lithium-ion ont la particularité de perdre en capacité au cours des dix premiers cycles. La perte n’est pas grande (quelques pour cent) et s’atténue au fur et à mesure. Cette perte dépend beaucoup des matériaux utilisés et n’est donc pas la même pour toutes les batteries, ni même systématiques.
La baisse s’explique néanmoins en raison du processus de fabrication de la cellule Li-ion. Au moment où la pile est fabriquée, le constructeur applique un cycle de charge/décharge qui forme une couche protectrice sur l’anode, mais qui a pour effet de consommer un peu de lithium. Cette couche va avoir tendance à s’affiner avec les premiers cycles, ce qui aura pour conséquence de consommer un peu plus de lithium encore. Moins de lithium signifie logiquement moins de capacité. Il est néanmoins très difficile de déterminer à quel point l’accu perd en capacité, sachant que ce phénomène varie en fonction des matériaux utilisés.
« L’effet de mémoire » : le vrai et le faux

Un faux problème
L’« effet de mémoire » est un phénomène qui caractérise une batterie qui refuse de délivrer toute l’énergie qu’elle a en magasin, car elle a été rechargée avant d’être totalement épuisée et a mémorisé le seuil atteint au moment de la recharge comme seuil d’épuisement.
Ce phénomène a été initialement découvert par la NASA. Ses satellites, mis sur orbite autour de la terre, se chargeaient pendant les périodes de jours et se déchargeaient pendant les périodes de nuit. Attention, les durées de charges/décharges sont restées parfaitement identiques. Après plusieurs charges/décharges, la NASA a remarqué que la batterie ne donnait plus d’énergie au-delà du point où elle avait l’habitude d’être déchargée. La batterie avait gardé en « mémoire » le seuil de décharge habituel et refusait d’aller plus loin.
Dans la vie courante, il est quasiment impossible de souffrir de l’effet de mémoire sur des batteries Ni/Cd. Les temps de charges et décharge sont rarement (voire jamais) scrupuleusement identiques au cours de plusieurs cycles successifs. Il faudrait que le consommateur cherche reproduire l’effet de mémoire ce qui est une hypothèse d’école. À vrai dire, même en laboratoire la reproduction de l’effet de mémoire s’avère difficile et l’utilisateur lambda ne craint donc rien.
Le vrai faux effet de mémoire
Néanmoins, les fabricants d’accumulateurs Ni/Cd et Ni/Mh ont désigné comme « effet de mémoire » un autre phénomène, celui de « la dépression de la tension » que l’on appelle aussi aujourd’hui le « faux effet de mémoire » en souvenir de ce désordre qui contrairement aux arguments de l’époque affecte tant les accus Ni/Cd que les Ni/MH, même si le premier souffre plus que le dernier. En gros, lorsqu’une batterie est branchée à son chargeur alors qu’elle est pleine (en moyenne pendant plus d’un jour après que la batterie ait été totalement chargée), le courant va engendrer une détérioration de la structure de l’accumulateur qui ne pourra délivrer qu’une tension inférieure (1,08 V/élément) à celle de la tension nominale des accus Ni/Cd (1,2 V/élément).
On se retrouve donc avec des accus qui délivrent la tension prévue et d’autre assurant une tension inférieure. Or, si l’appareil faisant appel à la batterie requiert la tension prévue, les accus détériorés ne pourront pas délivrer leur énergie et on aura l’impression qu’il s’agit d’un « effet de mémoire ». À titre d’information, sachez que ce phénomène peut être inversé sur les batteries Ni/Cd en déchargeant la batterie jusqu’à son seuil critique et en la rechargeant.
Le lithium-ion n’a pas de mémoire
On pourrait se demander si ce problème n’affecte pas les batteries au Li-ion, surtout celles qui restent dans un ordinateur portable lui-même branché sur une prise secteur. On pourrait avoir l’impression que dans ce cas de figure, la batterie pourrait souffrir d’une dépression de la tension, car elle est constamment en train d’être chargée. La réalité est tout autre et ce problème n’est pas présent dans les batteries au lithium-ion pour une raison simple. Au moment de la recharge, le chargeur donne une partie de l’énergie aux accus, l’autre partie étant allouée au fonctionnement de l’ordinateur. Voilà d’ailleurs pourquoi un utilisateur met plus de temps à charger sa batterie lorsque l’ordinateur est allumé que lorsqu’il est éteint et que le chargeur ne partage pas le courant qu’il envoie. Une fois les accus rechargés, le circuit électrique coupe le courant envoyé aux accus qui ne reçoivent automatiquement plus d’électricité, ce qui empêche par conséquent toute surcharge.
Heureusement d’ailleurs, les batteries Li-ion ont horreur de la surcharge (une surcharge produit de l’hydrogène et augmente la pression ce qui engendrer une explosion). Voilà pourquoi il est d’ailleurs impératif d’utiliser le chargeur fourni et de recharger sa batterie en suivant les indications du constructeur. Tous les produits numériques en passant de l’ordinateur portable au baladeur numérique sont livrés avec un chargeur et il est impératif de l’utiliser et de ne faire appel à aucun autre. Un chargeur non adapté pourrait causer une explosion. Par soucis de précision, nous indiquons qu’il est possible de se procurer un chargeur plus puissant que celui livré par le constructeur à condition qu’il ne dépasse pas la tension du chargeur d’origine.
Tension de charge
En moyenne la tension de charge pour les batteries d’ordinateur portable est en moyenne de 4,2 V/cellule et si jamais elle monte ne serait-ce que de 0,1 V/cellule, le circuit électrique est censé couper la charge. Auparavant, la limite était de 4,1 V/cellule, mais cette barrière fut franchie grâce à l’ajout d’agent chimique. Le problème est qu’une augmentation de la tension de charge pourrait accroître la capacité de l’accumulateur, mais réduirait grandement sa durée de vie.
Pourtant, si l’on prend le chargeur de notre ordinateur de test, on s’aperçoit que la tension inscrite est de 20 V. Comment expliquer cela ? Les accus de la batterie de notre ordinateur ont une structure 4S2P. Cela signifie que quatre cellules sont montées en série et la tension de recharge délivrée par le chargeur sera divisée par 4 (comme on multiplie par quatre la tension des accus pour déterminer la tension totale délivrée par la batterie). Sachant que 2 à 3 volts sont alloués à la régulation de la tension ou aux pertes électroniques, on se retrouve avec 17 V, soit 4,25 V/cellule, ce qui reste proche de la valeur mentionnée plus haut. On comprend donc aussi à quel point il est important d’utiliser le chargeur livré avec l’ordinateur pour être sûr de bénéficier d’une tension supportée par les piles.
Pour ceux qui ont encore besoin d’être convaincu, ces vidéos devraient vous « refroidir » (vidéo 1, vidéo 2, vidéo 3). Les batteries en question sont des li-ion polymères, mais restent représentatives de ce qui peut arriver en pratique avec des batteries li-ion. Nous tenons aussi à préciser que les supers chargeurs qui sont censés redonner vie à votre batterie lithium-ion sont à écarter. Une cellule morte ne peut être ressuscitée.
Ordinateur portable avec ou sans batterie ?

Garder sa batterie dans l’ordinateur
Comme nous l’avons vu précédemment, la température optimale de charge est 20 C et même si votre portable recharge votre batterie dès qu’elle perd 10 % il faudra 10 recharges de 10 % avant d’atteindre un cycle. N’ayez pas peur des petites recharges, bien au contraire. À température ambiante, nous savons que la batterie perd en moyenne 10 % par mois. 6 à 7 % sont attribués aux accumulateurs. Le circuit électrique est responsable de 3 % de perte en plus. Généralement, un ordinateur va procéder à une recharge dès que la batterie perd 5 % de charge. Deux recharges par mois ne poseront aucun problème et avoir sa batterie branchée sur son ordinateur ou sa batterie dans une étagère de votre armoire reviendra au même. En moyenne, sachez qu’un accumulateur Li-ion vie entre 500 et 1 000 cycles de charge.
D’ailleurs, si c’est pour stocker votre batterie dans une pièce à température ambiante, autant la laisser dans votre portable. En effet, si votre portable reste constamment branché, vous aurez tendance à l’oublier. Or, il est important d’effectuer un cycle complet de charge/décharge par mois en épuisant la batterie, mais en ne descendant pas en dessous de 5 %, dans le but de la calibrer. Avoir votre batterie dans votre ordinateur vous aidera à vous en souvenir.
Ne pas garder sa batterie
Garder la batterie dans la machine coule de source pour tous ceux qui en ont régulièrement besoin. Néanmoins, nous verrons plus loin que la batterie est mieux conservée au frais. Si votre portable chauffe de façon importante, après un temps d’utilisation relativement court (45 min – 1h) retirez-la, lorsque vous êtes sur secteur. L’ordinateur portable dispose d’éléments qui génèrent de la chaleur et qui peuvent augmenter la température de la batterie. D’ailleurs, si votre ordinateur portable chauffe beaucoup, il se peut qu’au moment où il va recharger la batterie, sa température dépasse largement les 20°C, ce qui est peu recommandable comme nous l’avons vu plus haut. Enfin, comme nous le verrons dans la page suivante, stocker sa batterie dans un endroit sec et froid (0 C) est une bonne idée si vous n’en faites pas usage pendant plusieurs mois. La retirer peut donc être judicieux. Attention néanmoins à ne pas oublier le cycle de charge/décharge mensuel visant à calibrer la batterie.
Attention danger

Changer ses accumulateurs demande une certaine expérience et exige exactement les mêmes piles. Toutes les piles ne se valent pas et toutes ne sont pas faites pour être utilisées en série ou en parallèle avec d’autres accus et chaque batterie demande son lot de pile bien précis. De plus les constructeurs d’accumulateurs li-ion ne vendent généralement qu’à des fabricants de batteries certifiés. On trouve néanmoins de plus en plus de « vendeurs libres » dans des pays émergents. Nos Samsung ICR-1850 étaient, par exemple, disponibles sur un site chinois. Néanmoins, nous vous déconseillons fortement de prendre ce chemin qui pourrait être dangereux pour la batterie, l’ordinateur et vous-même.
Stocker sa batterie

Attention, il est préférable d’atteindre les 40 % en chargeant et non en déchargeant la batterie. En effet, le système d’exploitation mesure le niveau de charge en fonction de l’activité actuelle de l’ordinateur. Par exemple, si le système est en pleine charge, il va calculer l’autonomie restante et déterminer le taux de charge approprié, mais ce chiffre peut rapidement changer si la fréquence de fonctionnement du processeur ou la clarté de l’écran baisse en cours de route. Même si aujourd’hui, le système est très précis, il est préférable, pour être certains d’avoir une mesure fiable, d’atteindre 40 % en chargeant la batterie.
Problème de chaleur
La chaleur impacte directement les accumulateurs. Il est donc crucial de garder sa batterie au frais et au sec. Le meilleur endroit est d’ailleurs le réfrigérateur. En effet, on estime qu’une batterie au Lithium-ion, chargée à 40 % et conservée à 0°C maintiendra 98 % de sa capacité sur une année. À 25°C (température ambiante en principe), on passe à 96 % de sa capacité, à 40°C on passe à 85 % et à 60°C, on passe à 75 %. Comme nous l’avons vu, en moyenne, une batterie perd environ 10 % de charge par mois. Comparativement, une batterie pleine et stockée pendant un an à une température de 0°C ne maintiendra que 94 % de sa capacité. À 25°C, on parle de 80 % contre 65 % à 40°C.
À titre d’information, sachez que l’électrolyte présente dans les accus gèlent à partir de -40°C (selon L.M Cristo et T. B Atwater dans le livre Characteristics and Behavior of 1M LiPF6 1EC:1DMC Electrolyte at Low Temperatures. Fort Monmouth, NJ : U.S. Army Research). Concrètement, cette valeur est discutée, certains parlant de -75°C, d’autres de -30°C. Nous avons choisi celle qui nous semble la plus sûre. Néanmoins, nous n’avons trouvé aucune source qui déconseille de placer sa batterie dans son frigo et de s’approcher le plus possible de 0°C, température optimale de stockage.
Il est aussi important de bien nettoyer les contacts métalliques de la batterie avec de l’alcool et de bien la sécher avant de la replacer dans son ordinateur. Cette opération, à réaliser tous les deux mois, assure une meilleure conductivité.
Les traces du temps

Enfin, une fois que votre batterie aura rendu l’âme, que faire ? Les risques pour l’environnement sont faibles alors que ces batteries sont conçues pour ne pas connaître de fuite et sont plus sûres que celles au cadmium par exemple. Néanmoins, il est clair que l’incinération va dégager des gaz toxiques. Si vous connaissez un programme de recyclage, alors bien évidemment, tirez-en parti en disposant de vos batteries dans les conteneurs appropriés. Vous pouvez aussi faire jouer la règle du « un pour un » mis en place lors de la transcription des directives européennes sur le recyclage des équipements électroniques dans le droit français par le décret d’application 2005-829.
Ce décret dispose, entre autres, qu’un revendeur (offline ou online) se doit de récupérer votre ancien matériel à condition que vous ayez acheté un produit similaire chez lui (un écran pour un écran, un PC pour un PC) et que vous en fassiez la demande. Sachez que l’enlèvement est censé être gratuit. Une batterie tombe sous la catégorie des déchets d’équipements électriques et électroniques (DEEE). Si vous achetez donc un ordinateur portable ou simplement une batterie, vous devriez être en droit de demander la reprise de la batterie ou de l’ordinateur par le revendeur. Après tout, l’écotaxe est justement là pour venir épauler les coûts de cet effort de recyclage.
Conclusion : Évolution et Création
La batterie Li-ion est loin d’être figée. Il y à peine plus de 10 jours, des chercheurs américains associés au département de l’Énergie aux États-Unis, ont présenté une nouvelle cathode. Elle avait la particularité d’être constituée d’une double couche de nanocristaux et de contenir une forte proportion de manganèse. Si la production de masse n’est pas encore envisageable en l’état, on annonce deux fois plus de puissance avec ce procédé.
Évolution
En 1999, le lithium-ion polymère a fait son apparition. Utilisé dans les petits périphériques requérants peu d’énergie (HP l’utilise par exemple dans ses Pocket PC ou ultra portable), son électrolyte est un polymère gélifié. L’avantage est que l’on obtient de plus petites batteries ayant toutes les formes possibles puisque le gel permet de s’abstenir d’une enveloppe métallique. L’autre bénéfice est un accu moins volatil et moins inflammable. Par contre, la densité énergétique est beaucoup moins grande qu’avec le Li-ion classique (cf. « Les batteries Lithium-Polymère remplaceront les Li-Ion »).
Une autre pile, toujours inspirée du Li-ion, commence à faire son apparition. Le Lithium-phosphate a la particularité d’utiliser une cathode contenant du fer et du phosphate pour un mélange de type LiFePO4, en lieu et place au traditionnel dioxyde de Cobalt. Elle a l’avantage d’être moins volatile et dangereuse. Elle fait en sorte que l’oxygène ne soit pas libéré facilement, ce qui empêche ainsi une réaction exothermique lorsque la température monte. Ces batteries sont encore introuvables et il est impossible de parler avec certitude de leur capacité. Initialement présentée en 1997 par des chercheurs de l’Université du Texas, située à Austin (USA) elle est le fer de lance de la société Valence.
Création
L
La deuxième partie de notre article sera consacrée à l’autonomie des batteries Lithium-ion dans les ordinateurs portables sous différents systèmes d’exploitation et ce qu’il faut savoir pour économiser de précieuses minutes.